Halaman ini menggambarkan dan menjelaskan cara menambahkan katalis mempengaruhi laju reaksi. Ini mengasumsikan bahwa Anda sudah akrab dengan ide-ide dasar tentang teori tabrakan laju reaksi, dan dengan distribusi Maxwell-Boltzmann energi molekul dalam gas. | |||||||||||||
Catatan: Jika Anda belum membaca halaman tentang teori tabrakan , Anda harus melakukannya sebelum Anda melanjutkan. Gunakan tombol BACK pada browser Anda untuk kembali ke halaman ini, atau kembali melalui tingkat menu reaksi. | |||||||||||||
| Perhatikan bahwa ini hanya melihat awal di katalisis sejauh itu mempengaruhi tingkat reaksi.
Jika Anda mencari lebih detail, ada bagian yang terpisah berurusan
dengan katalis yang dapat Anda akses melalui link di bagian bawah
halaman. Fakta-fakta Apa katalis? Katalis adalah zat yang mempercepat reaksi, tapi secara kimiawi tidak berubah pada akhir reaksi. Ketika reaksi selesai, Anda akan memiliki massa yang sama persis katalis seperti yang Anda miliki di awal. Beberapa contoh Beberapa contoh yang mungkin Anda butuhkan untuk bagian lain dari silabus mencakup:
| |||||||||||||
Catatan: Anda dapat menemukan rincian ini dan reaksi katalitik lainnya dengan menjelajahi menu untuk bagian utama pada katalisis. Anda akan menemukan link di bagian bawah halaman ini. | |||||||||||||
| Penjelasannya Pentingnya kunci dari energi aktivasi Tabrakan hanya menghasilkan reaksi jika partikel-partikel bertumbukan dengan energi minimum tertentu yang disebut energi aktivasi untuk reaksi. | |||||||||||||
Catatan: Berikut beranggapan Anda memiliki ide yang masuk akal tentang energi aktivasi dan hubungannya dengan distribusi Maxwell-Boltzmann. Hal ini tercakup pada halaman pengantar tentang teori tabrakan . Jika Anda tidak yakin tentang ini, ikuti link ini, dan gunakan tombol BACK pada browser Anda untuk kembali ke halaman ini. | |||||||||||||
Anda dapat menandai posisi dari energi aktivasi pada distribusi Maxwell-Boltzmann untuk mendapatkan diagram seperti ini: 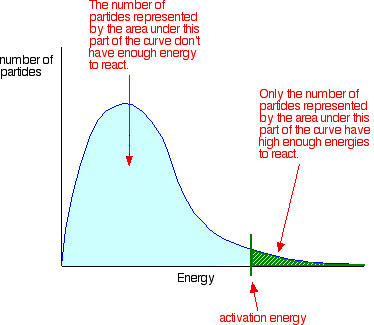 Katalis dan energi aktivasi Untuk meningkatkan laju reaksi Anda perlu meningkatkan jumlah tumbukan yang sukses. Salah satu cara yang mungkin untuk melakukan ini adalah untuk memberikan cara alternatif untuk reaksi terjadi yang memiliki energi aktivasi yang lebih rendah. Dengan kata lain, untuk memindahkan energi aktivasi pada grafik seperti ini: 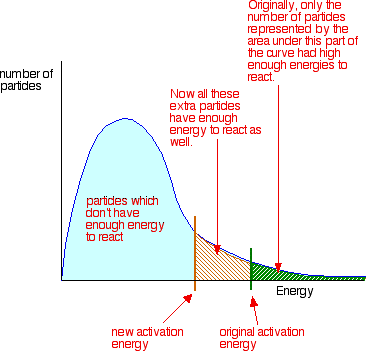 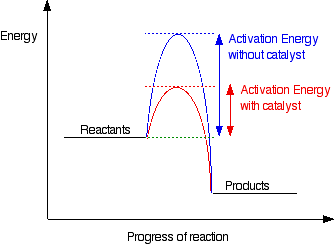
Misalnya Anda memiliki sebuah gunung di antara dua lembah sehingga satu-satunya cara bagi orang untuk mendapatkan dari satu lembah ke yang lain adalah naik gunung. Hanya orang yang paling aktif akan mengelola untuk mendapatkan dari satu lembah ke yang lain. Sekarang anggaplah sebuah terowongan yang menembus gunung. Banyak orang lebih sekarang akan mengelola untuk mendapatkan dari satu lembah ke yang lain dengan rute ini lebih mudah. Anda bisa mengatakan bahwa rute terowongan memiliki energi aktivasi yang lebih rendah daripada pergi naik gunung. Tapi Anda belum menurunkan gunung! Terowongan itu telah memberikan jalur alternatif tetapi tidak menurunkan yang asli. Gunung asli masih ada, dan beberapa orang masih akan memilih untuk mendaki itu. Dalam kasus kimia, jika partikel bertumbukan dengan energi yang cukup mereka masih dapat bereaksi dengan cara yang persis sama seperti jika katalis tidak ada. Ini hanyalah bahwa sebagian besar partikel akan bereaksi melalui rute katalis lebih mudah. | |||||||||||||
MENU MURNI'S BLOG
Artikel Populer
-
Untuk membuat larutan asam sulfat encer dari larutan asam sulfat pekat 98% maka langkah pertama adalah dengan menghitung terlebih dahulu m...
-
PENENTUAN HASIL KALI KELARUTAN PbI 2 I. Tujuan Mempelajari cara penentuan hasil ...
-
Awal pertama kerja di sebuah perusahaan bidang jasa yang terletak di kalimantan timur. Pertama kali hidup sendiri di kampung orang demi menc...
-
I. TUJUAN - Dapat menjelaskan prinsip kromatografi gas. - Dapat menganalisa sample yang sederhana de...
-
Semester I kimia Analis Kimia Dasar K3 Kewarga negaraan Agama Bahasa Inggris Lab. Kimia Dasar Lab komputer
-
1. Harvard University, United States Universitas Harvard dinilai sebagai universitas nomor satu di Peringkat Universitas Dunia 2009. Harv...
-
HUKUM KEKEKALAN MASSA I. TUJUAN Setelah saya melakukan percobaan, saya dapat menentukan...
-
Pengendalian Level 1. TUJUAN : q Mengetahui prinsip alat pengukur ketinggian level switch dan differential switch. q Mengetah...
-
Kristalisasi merupakan salah satu cara untuk memisahkan zat padat dari komponen-komponen lain penyusun campuran. Kristalisasi ada dua ma...
-
Halaman ini melihat pada berbagai jenis katalis (heterogen dan homogen) dengan contoh-contoh dari tiap jenis, dan penjelasan tentang baga...
Saturday, 19 May 2012
PENGARUH katalis TENTANG TARIF REAKSI
Subscribe to:
Post Comments (Atom)





0 comments:
Post a Comment
Komentarnya!!!!!!!!!