| Halaman ini melihat pada berbagai jenis katalis (heterogen dan homogen) dengan contoh-contoh dari tiap jenis, dan penjelasan tentang bagaimana mereka bekerja. Anda juga akan menemukan deskripsi dari satu contoh dari autocatalysis - reaksi yang dikatalisis oleh salah satu produknya. | |
Catatan: Halaman ini tidak berurusan dengan efek katalis pada tingkat reaksi . Jika Anda belum tahu tentang itu, mungkin Anda sukai untuk mengikuti link ini dulu. Kembali ke halaman ini melalui tombol BACK pada browser Anda. | |
| Jenis reaksi katalitik Katalis dapat dibagi menjadi dua jenis utama - heterogen dan homogen. Dalam reaksi heterogen, katalis berada dalam fase berbeda dari reaktan. Dalam reaksi homogen, katalis berada dalam fase yang sama dengan reaktan. Apa itu fase? Jika Anda melihat suatu campuran dan dapat melihat batas antara dua komponen, zat tersebut berada dalam fase yang berbeda. Campuran yang berisi padat dan cair terdiri dari dua tahap. Campuran berbagai bahan kimia dalam larutan tunggal hanya terdiri dari satu fase, karena Anda tidak bisa melihat batas antara mereka. 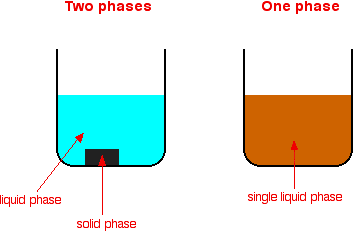 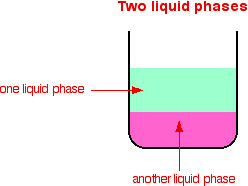 Katalisis heterogen Ini melibatkan penggunaan katalis dalam fase berbeda dari reaktan. Contoh umum melibatkan katalis padat dengan reaktan baik sebagai cairan atau gas. | |
Catatan: Anda harus selalu mengingat perbedaan antara dua istilah heterogen dan homogen. hetero berarti berbeda (seperti dalam heteroseksual). Katalisis heterogen memiliki katalis dalam fase berbeda dari reaktan. homo berarti sama (seperti dalam homoseksual). Katalisis homogen memiliki katalis dalam fase sama dengan reaktan. | |
| Cara kerja katalis heterogen (secara umum) Contoh yang paling katalisis heterogen melalui tahapan yang sama:
Perak, misalnya, bukan katalis yang baik karena tidak membentuk lampiran yang cukup kuat dengan molekul reaktan. Tungsten, di sisi lain, tidak katalis yang baik karena adsorbsi terlalu kuat. Logam seperti platinum dan nikel membuat katalis yang baik karena mereka menyerap cukup kuat untuk menahan dan mengaktifkan reaktan, tapi tidak begitu kuat bahwa produk tidak dapat melepaskan diri. Contoh katalisis heterogen Hidrogenasi ikatan karbon-karbon rangkap Contoh paling sederhana dari hal ini adalah reaksi antara eten dan hidrogen dengan adanya katalis nikel. Dalam prakteknya, ini adalah reaksi sia-sia, karena Anda mengubah etena sangat berguna ke dalam etana yang relatif tidak berguna. Namun, reaksi yang sama akan terjadi dengan senyawa yang mengandung ikatan karbon-karbon ganda. Salah satu penggunaan industri yang penting adalah dalam hidrogenasi minyak nabati untuk membuat margarin, yang juga melibatkan reaksi ikatan karbon-karbon rangkap dalam minyak nabati dengan hidrogen dengan adanya katalis nikel. Molekul etena yang teradsorpsi pada permukaan nikel. Ikatan rangkap antara atom karbon istirahat dan elektron yang digunakan untuk obligasi ke permukaan nikel. 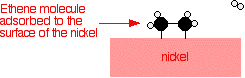 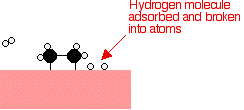 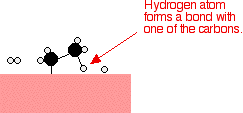 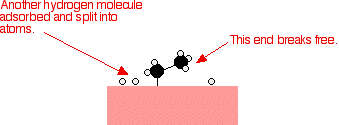 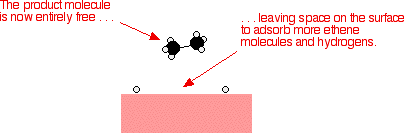 | |
Catatan: Beberapa logam, termasuk nikel, memiliki kemampuan untuk menyerap hidrogen ke dalam struktur mereka serta menyerap pada ke permukaan. Dalam kasus ini, molekul hidrogen juga diubah menjadi atom yang dapat menyebar melalui struktur logam. Hal ini terjadi dengan nikel jika hidrogen berada di bawah tekanan tinggi, tapi saya belum dapat menemukan informasi tentang apakah itu juga merupakan b diserap di bawah tekanan yang lebih rendah biasanya digunakan untuk reaksi hidrogenasi. Karena itu saya telah terjebak dengan penjelasan biasa dalam hal penyerapan d. Jika seseorang memiliki informasi tentang perusahaan ini, mereka bisa menghubungi saya melalui alamat di tentang situs ini halaman. | |
| Catalytic converter Catalytic converter mengubah molekul beracun seperti karbon monoksida dan nitrogen oksida berbagai knalpot mobil menjadi molekul berbahaya lebih seperti karbon dioksida dan nitrogen. Mereka menggunakan logam mahal seperti platina, paladium dan rhodium sebagai katalis heterogen. Logam yang disimpan sebagai lapisan tipis ke sarang lebah keramik. Ini memaksimalkan luas permukaan dan menjaga jumlah logam yang digunakan untuk minimum. Mengambil reaksi antara karbon monoksida dan nitrogen monoksida sebagai khas: Pada jenis yang sama cara seperti contoh sebelumnya, karbon monoksida dan nitrogen monoksida akan teradsorpsi pada permukaan katalis, di mana mereka bereaksi. Karbon dioksida dan nitrogen yang kemudian desorbed. Catalytic converter dapat dipengaruhi oleh keracunan katalis. Hal ini terjadi ketika sesuatu yang bukan merupakan bagian dari reaksi menjadi sangat kuat teradsorpsi ke permukaan katalis, mencegah reaktan normal dari mencapai itu. Timbal adalah racun katalis akrab untuk catalytic converters. Ini melapisi sarang lebah dari logam mahal dan berhenti bekerja. Di masa lalu, senyawa timbal yang ditambahkan ke bensin (bensin) untuk membuatnya membakar lebih lancar di mesin. Tapi Anda tidak bisa menggunakan konverter katalitik jika Anda menggunakan bahan bakar bertimbal. Konverter katalitik Jadi tidak hanya membantu menghilangkan gas beracun seperti karbon monoksida dan nitrogen oksida, tetapi juga memaksa penghapusan senyawa timbal beracun dari bensin. Penggunaan vanadium (V) oksida pada Proses Contact Selama Proses kontak untuk pembuatan asam sulfat, belerang dioksida harus diubah menjadi belerang trioksida. Hal ini dilakukan dengan melewatkan belerang dioksida dan oksigen melalui katalis (V) oksida padat vanadium. | |
Catatan: persamaan ini ditulis dengan setengah di dalamnya untuk membuat penjelasan di bawah ini lebih rapi. Anda mungkin akrab dengan persamaan ditulis sebagai dua kali ditampilkan, namun versi ini bisa diterima. Hal ini juga ditampilkan sebagai satu arah daripada reaksi reversibel untuk menghindari hal-hal rumit. | |
| Contoh ini sedikit berbeda dari yang sebelumnya karena gas sebenarnya bereaksi dengan permukaan katalis, sementara mengubahnya. Ini adalah contoh yang baik dari kemampuan logam transisi dan senyawa mereka untuk bertindak sebagai katalis karena kemampuan mereka untuk mengubah tingkat oksidasi mereka. | |
Catatan: Jika Anda tidak yakin tentang oksidasi , hal ini mungkin berguna untuk mengikuti link ini sebelum Anda melanjutkan. Gunakan tombol BACK pada browser Anda untuk kembali ke halaman ini. | |
| Belerang dioksida dioksidasi menjadi sulfur trioksida oleh oksida (V) vanadium. Dalam prosesnya, vanadium (V) oksida direduksi menjadi vanadium (IV) oksida. Vanadium (IV) oksida kemudian kembali dioksidasi oleh oksigen. Ini adalah contoh yang baik dari cara bahwa katalis dapat diubah selama reaksi. Pada akhir reaksi, meskipun, itu akan secara kimia sama seperti itu dimulai. | |
Catatan: Jika Anda ingin lebih detail tentang Proses Contact , Anda akan menemukan deskripsi lengkap dari kondisi yang digunakan dan alasan bagi mereka dengan mengikuti link ini. | |
| Homogen katalisis Ini memiliki katalis dalam fase yang sama dengan reaktan. Biasanya semuanya akan hadir sebagai gas atau terkandung dalam fase cair tunggal. Contoh berisi salah satu dari masing-masing. . . Contoh katalisis homogen Reaksi antara ion persulfat dan ion iodida Ini adalah reaksi solusi yang Anda mungkin hanya memenuhi dalam konteks katalisis, tetapi merupakan contoh indah! Persulfat ion (ion peroxodisulphate), S 2 O 8 2 -, adalah agen pengoksidasi yang sangat kuat. Ion iodida sangat mudah dioksidasi menjadi iodin. Namun reaksi antara mereka dalam larutan dalam air sangat lambat. Jika Anda melihat persamaan, mudah untuk melihat mengapa itu adalah: Reaksi perlu tabrakan antara dua ion negatif. Tolakan akan mendapatkan serius di jalan itu! Reaksi dikatalisis menghindari masalah itu sepenuhnya. Katalis dapat berupa besi (II) atau (III) ion besi yang ditambahkan ke larutan yang sama. Ini adalah satu lagi contoh yang baik dari penggunaan senyawa logam transisi sebagai katalis karena kemampuan mereka untuk mengubah tingkat oksidasi. Demi argumen, kita akan menjadi katalis besi (II). Seperti yang akan Anda lihat segera, itu tidak benar-benar peduli apakah Anda menggunakan besi (II) atau (III) ion besi. Ion-ion persulfat mengoksidasi besi (II) menjadi besi (III) ion. Dalam proses ini ion persulfat direduksi menjadi ion sulfat. Besi (III) ion kuat agen pengoksidasi yang cukup untuk mengoksidasi ion iodida menjadi iodin. Dalam prosesnya, mereka mengurangi kembali ke besi (II) lagi. Kedua tahap ini individu dalam keseluruhan reaksi melibatkan tumbukan antara ion positif dan negatif. Ini akan jauh lebih mungkin berhasil dari tabrakan antara dua ion negatif dalam reaksi esterifikasi tanpa katalis. Apa yang terjadi jika Anda menggunakan besi (III) ion sebagai katalis bukan (II) ion besi? Reaksi hanya terjadi dalam urutan yang berbeda. Kerusakan ozon atmosfer Ini adalah contoh yang baik katalisis homogen dimana semuanya hadir sebagai gas. Ozon, O 3, terus-menerus terbentuk dan dipecah lagi dalam suasana tinggi oleh aksi sinar ultraviolet. Molekul oksigen biasa menyerap sinar ultraviolet dan istirahat menjadi atom oksigen individu. Ini memiliki elektron tidak berpasangan, dan dikenal sebagai radikal bebas. Mereka sangat reaktif.  Radikal oksigen kemudian dapat menggabungkan dengan molekul oksigen biasa untuk membuat ozon. Ozon juga dapat dibagi lagi menjadi oksigen biasa dan oksigen radikal dengan menyerap sinar ultraviolet. Ini pembentukan dan putus ozon yang terjadi sepanjang waktu. Secara keseluruhan, reaksi menghentikan banyak radiasi ultraviolet yang berbahaya menembus atmosfer untuk mencapai permukaan Bumi. Reaksi katalitik kita tertarik menghancurkan ozon dan berhenti itu menyerap UV dengan cara ini. Chlorofluorocarbon (CFC) seperti CF 2 Cl 2, misalnya, digunakan secara luas dalam aerosol dan sebagai refrigeran. Rincian lambat mereka di atmosfer menghasilkan atom klorin - radikal bebas klorin. Ini mengkatalisis penghancuran ozon. Hal ini terjadi dalam dua tahap. Pada bagian pertama, ozon rusak dan bebas baru yang radikal dihasilkan. Katalis radikal klorin dibuat ulang oleh reaksi kedua. Hal ini dapat terjadi dengan dua cara tergantung pada apakah radikal CLO hits molekul ozon atau oksigen radikal. Jika hits oksigen radikal (dihasilkan dari salah satu reaksi kita telah melihat sebelumnya): 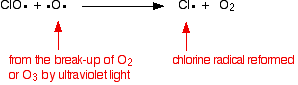 Atau jika hits molekul ozon: 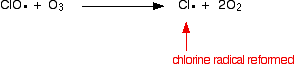 Karena radikal klorin yang terus diperbaharui, masing-masing dapat merusak ribuan molekul ozon. | |
Catatan: Jika Anda seorang Inggris Seorang mahasiswa tingkat besar kemungkinan bahwa Anda hanya akan ingin salah satu dari dua persamaan terakhir tergantung pada apa silabus mengatakan. Sayangnya, pada saat penulisan, berbeda tingkat A silabus yang mengutip persamaan akhir yang berbeda. Anda perlu memeriksa silabus Anda saat ini. Jika Anda tidak memiliki salinan Anda silabus , ikuti link ini untuk mengetahui bagaimana untuk mendapatkan satu. | |
| Autocatalysis Oksidasi asam ethanedioic oleh manganat (VII) ion Dalam autocatalysis, reaksi ini dikatalisis oleh salah satu produknya. Salah satu contoh sederhana dari hal ini adalah dalam oksidasi larutan asam ethanedioic (asam oksalat) dengan larutan diasamkan dari kalium manganat (VII) (kalium permanganat). Reaksi sangat lambat pada suhu kamar. Hal ini digunakan sebagai titrasi untuk mencari konsentrasi larutan kalium manganat (VII) dan biasanya dilakukan pada suhu sekitar 60 ° C Meskipun demikian, sangat lambat untuk memulai dengan. Reaksi ini dikatalisis oleh mangan (II). Ada jelas tidak ada yang hadir sebelum reaksi dimulai, dan sehingga dimulai sangat lambat pada suhu kamar. Namun, jika Anda melihat persamaan, Anda akan menemukan mangan (II) antara produk. Katalis Semakin banyak diproduksi sebagai hasil reaksi dan reaksi mempercepat. Anda dapat mengukur efek ini dengan memplot konsentrasi suatu reaktan seiring waktu. Anda mendapatkan grafik cukup berbeda dengan kurva normal untuk tingkat reaksi. Kebanyakan reaksi memberikan kurva tingkat yang terlihat seperti ini: 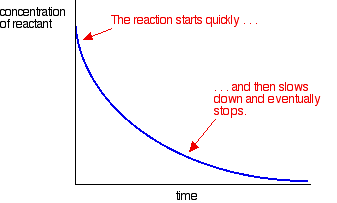 Contoh autocatalysis memberikan kurva seperti ini: 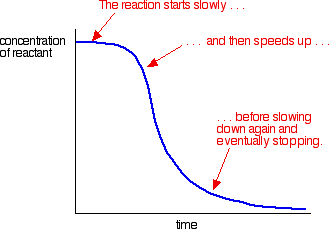 Peringatan! Jangan berasumsi bahwa kurva laju yang terlihat seperti ini selalu menunjukkan contoh autocatalysis. Ada efek lain yang mungkin menghasilkan grafik yang sama. Misalnya, jika reaksi yang terlibat padat bereaksi dengan cairan, mungkin ada semacam lapisan permukaan pada cairan padat yang harus menembus sebelum reaksi yang diharapkan bisa terjadi. Kemungkinan yang lebih umum adalah bahwa Anda memiliki reaksi sangat eksotermis dan tidak mengontrol suhu dengan benar. Panas berevolusi selama reaksi mempercepat reaksi ke atas | |
MENU MURNI'S BLOG
Artikel Populer
-
Untuk membuat larutan asam sulfat encer dari larutan asam sulfat pekat 98% maka langkah pertama adalah dengan menghitung terlebih dahulu m...
-
Ash Fusion Temperature yaitu menggambarkan karakteristik pelunakan dan pelelehan ash, dan diukur menurut standar prosedur tertentu deng...
-
Halaman ini melihat pada berbagai jenis katalis (heterogen dan homogen) dengan contoh-contoh dari tiap jenis, dan penjelasan tentang baga...
-
Ada kekuatan di dalam cinta. Dan orang yang sanggup memberikan cinta adalah orang yang kuat, karena ia bisa mengalahkan keinginannya untuk...
-
Berselancar didunia nampaknya sekarang menjadi hobi baru ku, klik sana, klik sini, buka situs ini, buka situs itu. Ngeliat perub...
-
Sahabat ada kalanya kita tak mampu menahan emosi sehingga cepat bad mood, ngambek, atau marah. Ternyata bukan hanya resiko penuaan din...
-
Pengendalian Level 1. TUJUAN : q Mengetahui prinsip alat pengukur ketinggian level switch dan differential switch. q Menge...
-
Foto Kampus Top Dunia Sekolah ke luar negeri? nampak pertanyaan itu sudah tidak asing lagi di kalangan pelajar dan mahasiswa Indonesia saat...
-
Daya Oksidasi Relatif Halogen DAN Identifikasi Alkali Tanah-Halida I. Tujuan Percobaan : ...
Saturday, 19 May 2012
Jenis - jenis Katalis
Subscribe to:
Post Comments (Atom)





kita juga punya nih artikel mengenai 'Katalis', silahkan dikunjungi dan dibaca , berikut linknya
ReplyDeletehttp://repository.gunadarma.ac.id/bitstream/123456789/894/1/20403528.pdf
trimakasih
semoga bermanfaat